医疗器械人因工程实际上是医疗器械开发中建立的一个过程,贯穿整个产品开发,注册上市,以及上市后监控的全过程。我们可以划分为三个阶段:洞察阶段,迭代阶段,和确认阶段。主要目的是开发出更加安全有效,易于使用,用户满意的医疗器械。
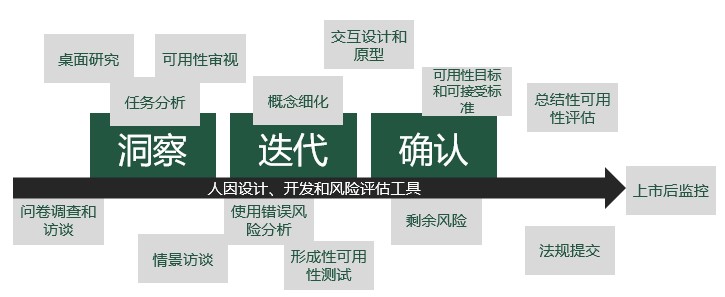
第一阶段:洞察

获得整个项目的洞察是实施医疗器械可用性/人因工程的开始,通常,我们需要运用多种方法来获得洞察以帮助整个可用性工程计划的完成。在开始阶段,通过桌面研究来明确设备设计的复杂程度和设备设计相关的法律法规要求是不错的选择。其次,往往需要通过任务分析和情景访谈等方法可以获得关于目标用户和设备具体使用环境的相关信息。这些信息对我们进行后续的设计及迭代起着至关重要的作用。比如用户的需求和偏好可以转化为UI设计的需求等。
第二阶段:迭代
通过对获得的洞察的概念细化,这个阶段已经做出了产品的交互设计并产生了相关的产品原型。在这个阶段工作的重点在于对原型的形成性评估测试,以便于根据测试结果进行的后续迭代开发,使之能够达到可用性工程的标准。形成性评估测试可以进行一次或者多次,关键在于是否能达到风险控制的目的。
在进行风险控制时,通常首先需要先识别与“使用相关”的风险,其中,既需要识别到与安全性和潜在使用错误相关的用户界面特征,也需要识别已知和可预知的危险与危险情景。测试之后需要进一步对使用错误风险进行分析,制定降低风险的方案,做好预算并完成对“降低风险”项目的实际安排。在提升产品本身的安全性的同时,为总结性评估做好准备,减少总结性评估的工作量。

第三阶段:确认

经过第二步的迭代开发,现在产品已经能够满足风险管理的相关要求。需要最后的确认研究来完成相关的注册审查。因为风险控制最终的目的并不是零风险,所以要建立可用性目标和可接受的标准,以满足相应的法律法规要求为底线。在方法上,通过总结性可用性评估可以明确相应的剩余风险,需要根据测试结果对风险及控制做出说明,完成HF/UE的可用性报告。
之后在支持注册审查的过程中回答关于HF/UE报告中相关的细节问题,例如“可接受标准(Acceptance Criteria)”中每个任务的“操作险肇(Close Call)”和“使用困难点”需要给出具体的使用情况及风险解决方法。最后,在获得准入之后,需要配合上市后的监控做出相应的调整。
不知道如何实施人因工程?
即刻上手人因工程测试评估


